LES TITRAGES ACIDE-BASE
1.
Définition de titrage (titration, dosage)
Le titrage d'une solution est une technique permettant de déterminer la concentration inconnue d'un soluté. À cet effet, on utilise une solution titrante
de concentration connue dont le soluté peut réagir avec le soluté de l'autre solution. On ajoute progressivement de petits volumes de solution titrante à un volume déterminé de solution titrée.
Un point d'équivalence du titrage est atteint lorsque l'agent titrant et l'espèce titrée ont réagi dans des proportions stœchiométriques.
Remarque
: dans le cas d'un acide ou d'une base appartenant à une série dont l'acide
est polyprotique, le titrage devrait présenter plusieurs points
d'équivalence (un par hydrogène "salifiable" de
l'acide). Ainsi, la "neutralisation"
complète de H3PO4 (phosphate d'hydrogène)
devrait présenter, en théorie, trois points équivalents.
2. pH à l'équivalence des titrages acidobasiques
|
Titrage
|
Équivalence
|
|
d'un acide fort par une base forte
d'une base forte par un acide fort
|
pH = 7
|
|
d'un acide faible par une base forte
|
pH
> 7
|
|
d'une base faible par un acide fort
|
pH
< 7
|
3.
Détermination du point d'équivalence à l'aide d'un indicateur
coloré
Un
indicateur coloré est une substance du type acide/base dont la
coloration de la forme acide est différente de celle de la forme
basique. Chaque indicateur possède sa zone de virage.
|
Indicateur
|
Zone de virage (pH)
|
|
Thymolphtaléine
Phénolphtaléine
Rouge neutre
Bleu de bromothymol
Tournesol
Rouge de méthyle
Vert de bromocrésol
Méthylorange
|
9.3 - 10.5
8.0 - 10.0
6.8 - 8.0
6.0 - 7.6
5.0 - 8.0
4.4 - 6.2
3.8 - 5.4
3.0 - 4.4
|
Pour apprécier le terme d'un titrage, l'indicateur le plus approprié
est celui dont la zone de virage encadre de manière optimale le
pH du point d'équivalence.
4. Modèle mathématique de la courbe de titrage
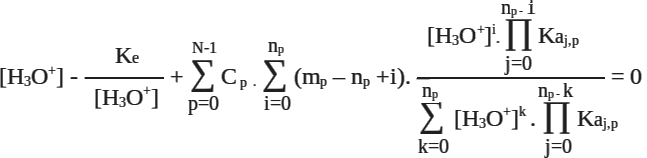
Ke= 10-14 mol2.L-2,
C = concentration,
N = nombre de séries acidobasiques,
np = nombre de pKa de la série p,
mp = numéro d'ordre de l'entité dans la série,
Ka = constante d'acidité.



