Les corps purs solides sont :
Dans les solides, les particules occupent chacune une position relativement fixe. Toutefois, si au zéro absolu ( 0 K = -273°C ) elles sont immobiles, des mouvements de vibration de plus en plus amples apparaissent lorsque la température augmente. Ceci permet d'expliquer le phénomène de dilatation thermique des solides observé au niveau macroscopique.
Au sein de la matière, les particules ultimes d'un solide cristallin sont organisées, si elles sont désordonnées, le solide est amorphe (sans forme).
Remarque : Pour les solides réduits en poudre, les caractéristiques de l'état solide ne se retrouvent qu'au niveau des grains.
Dans un cristal, les particules constitutives sont ordonnées. La structure résulte de la répétition dans les trois dimensions d'unités de base appelées "mailles".
Les systèmes cristallins les plus courants sont :
ex.: structure cristalline du polonium et sa maille.
Remarque: Pour être rigoureux, dans cette maille, les atomes devraient être représentés par des huitièmes de sphère

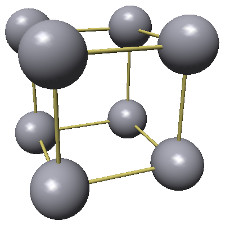
ex.: structure cristalline du fer et sa maille (l'atomium est sa représentation à très grande échelle).
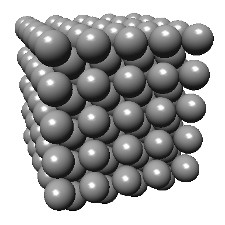
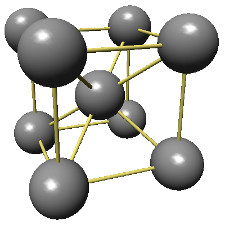
ex.: cristal de chlorure de sodium et sa maille.
Le chlore occupe les sommets et les centres des faces. Le sodium est situé au milieu des arêtes et au centre du cube.
Il constitue un autre réseau cubique à faces centrées décalé d'une demi-arête par rapport à celui du chlore.
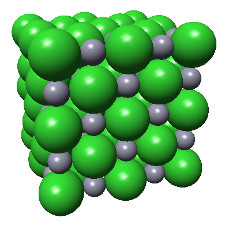
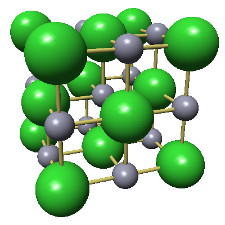
ex.: structure cristalline du zinc et sa maille.
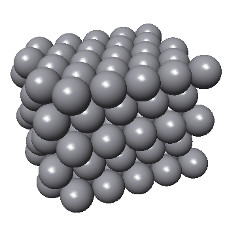
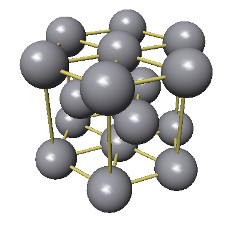
Le diamant a une structure tétraédrique (dérivée du modèle cubique). Les liaisons C-C sont très fortes. Elles résultent de recouvrements d'orbitales hybridées "sp3".
Dans le graphite, les atomes de carbone sont placés aux sommets d'hexagones, eux-même disposés dans des plans parallèles, glissant les uns sur les autres.
Les liaisons chimiques entre les carbones des différents plans sont faibles, elles sont assurées par des recouvrements d'orbitales "p" non-hybridées.
Les liaisons entre les carbones coplanaires sont plus fortes, elles résultent de recouvrements d'orbitales hybridées "sp2".
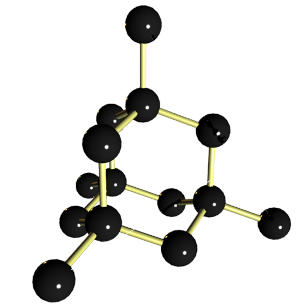
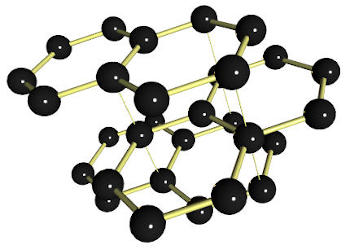
Il y a au moins dix variétés allotropiques de l'eau solide. Elles dérivent du système cubique et du système hexagonal. À la pression atmosphérique normale et jusqu'à environ 2000 bars, les molécules d'eau s'organisent en un réseau hexagonal. Sous une pression supérieure à 3000 bars et à une température proche de 0°C, elles s'organisent en structures tétraédriques (comme le diamant).
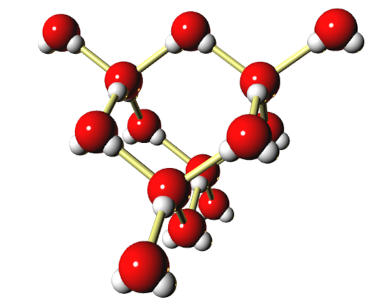

Dans ces solides, les particules ne sont pas ordonnées. Leur désorganisation se rapproche d'un liquide "figé".
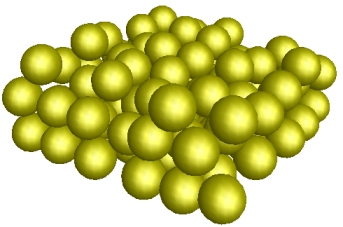
Ex.: le modèle moléculaire du soufre amorphe (polycaténasoufre).
Chaque atome de soufre est représenté par une sphère jaune. La molécule est constituée d'un assemblage d'un grand nombre d'atomes.