L'état liquide

1. Nature des liquides à température ordinaire
Les corps purs liquides sont :
- des corps simples (molécules homonucléaires) : seuls deux corps simples sont liquides à 25°C : un métal, le mercure et un non-métal, le brome. Citons aussi le gallium et le césium qui fondent à des températures inférieures à 30°C.
- de nombreux corps composés (molécules hétéronucléaires) : l'eau, l'acide sulfurique, des substances organiques comme les premiers hydrocarbures et les premiers alcools, etc.
2. Propriétés générales des liquides
- leur volume est défini,
- ils ne possèdent pas de forme propre, ils adoptent la forme de leur contenant dans un champ de pesanteur,
- ils sont peu compressibles car les distances intermoléculaires sont très faibles.
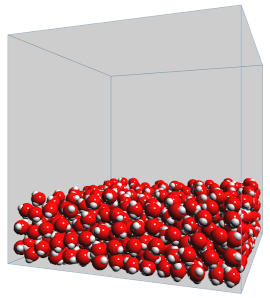
3. Organisation des liquides
Dans un liquide, les particules se déplacent en ligne droite entre deux collisions. Cependant comme elles sont très proches les unes des autres, elles se bousculent et semblent animées de mouvements vibratoires désordonnés dont le point d'équilibre se déplace en permanence. Le phénomène de diffusion d'un colorant dans un liquide est une manifestation macroscopique de cette organisation particulière.
Comme dans l'état gazeux, l'énergie cinétique des molécules est une fonction de la température
Ec = 3/2 RT, et la répartition statistique
des vitesses moléculaires respecte également la distribution de Maxwell-Boltzmann :
N(v)=4πv2.(m/2πkT)3/2.exp(-mv2/2kT)


